Adipositas: Transkriptionsfaktor C/EBPβ beeinflusst Fettspeicherung positiv
- 13.07.2022
- Print-News
- Redaktion
Bei Adipositas kommt es zu einer übermäßigen Vermehrung des Körperfetts und dessen Ansammlung im Gewebe. Wer daran erkrankt, hat zudem ein erhöhtes Risiko für Begleit- oder Folgeerkrankungen wie Diabetes mellitus Typ 2, Fettleber oder Atherosklerose. Forschende des European Research Institute for the Biology of Ageing (ERIBA) in Groningen, Niederlande, und des Leibniz-Instituts für Alternsforschung - Fritz-Lipmann-Institut (FLI) in Jena wiesen im Mausmodell nach, wie der Transkriptionsfaktor C/EBPβ selbst bei besonders fettreicher Ernährung die Fettspeicherung positiv beeinflussen und die Gesundheit erhalten kann.
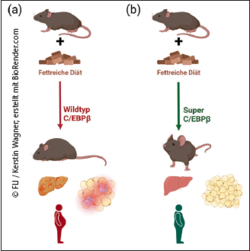
In den letzten Jahren haben Übergewicht und Adipositas in den Industrienationen stark zugenommen. In Deutschland ist jede/r Zweite übergewichtig, etwa 20 % der Bevölkerung sind adipös. Bei Adipositas kommt es meist zu einer Fettansammlung in stark vergrößerten (hypertrophen) Fettzellen (Adipozyten) im Bauchraum. Dieses viszerale Fett ruft Entzündungen hervor, die die Entwicklung und das Fortschreiten verschiedener Stoffwechselstörungen begünstigen. Forschende des ERIBA und FLI konnten nachweisen, dass genetisch veränderte Mäuse mit einer erhöhten Funktion des Transkriptionsfaktors C/EBPβ überschüssiges Fett so abspeichern können, dass sie selbst unter Stressbedingungen, z. B. einer ausgesprochen fettreichen Diät, gesund bleiben.
Die Fettspeicherung im viszeralen Fettdepot erfolgt v. a. durch die (begrenzte) Größenzunahme einzelner Fettzellen (hypertrophe Fettspeicherung). Eine fortdauernde Fettzufuhr führt so zur schädlichen Anhäufung von Fett im Gewebe außerhalb der Fettdepots (Steatose), insb. in Leber und Muskeln, was eine Beeinträchtigung der Funktion dieser Gewebe zur Folge hat. „Es gibt aber eine Untergruppe von Menschen, die trotz ihrer Fettleibigkeit über einen längeren Zeitraum hinweg keine erkennbaren gesundheitlichen Probleme aufweisen“, berichtet Prof. Cornelis Calkhoven, früherer Forschungsgruppenleiter am FLI und nun am ERIBA tätig.
Bisherige Studien konnten zeigen, dass Fett, welches nicht im Bauchraum, sondern subkutan unter der Haut der Arme, Oberschenkel und des Rückens gespeichert ist, die Gesundheit begünstigt, ebenso Fett, das im sog. hyperplastischen Fettgewebe gespeichert wird. Dieses wird durch eine Zunahme der Anzahl der Fettzellen gebildet (hyperplastische Fettspeicherung). Da so mehr Zellen für die Fettspeicherung zur Verfügung stehen, bleiben diese kleiner und sind dadurch metabolisch gesünder und weniger entzündet.
Werden Mäuse im Labor mit einer fettreichen Diät gefüttert, nehmen sie schnell an Gewicht zu, werden adipös und entwickeln ähnliche Stoffwechselprobleme wie Menschen mit Adipositas. „In unserer aktuellen Studie konnten wir zeigen, dass genetisch veränderte Mäuse mit einer erhöhten Funktion des Transkriptionsfaktors C/EBPβ einerseits überschüssiges Fett vorrangig im hyperplastischen Fettgewebe mit mehr und kleineren Fettzellen abspeichern“, berichtet Dr. Christine Müller vom ERIBA. Selbst bei extrem fettreicher Diät weisen diese C/EBPβ-Superfunktionsmäuse ein weniger entzündetes Fettgewebe auf, sammeln kein Fett in der Leber oder im Herzen an und bewahren einen gesunden Glukosestoffwechsel. Andererseits stimuliert die C/EBPβ-Superfunktion bei männlichen Tieren zudem die günstige Einlagerung von Fett in Depots unter der Haut. „Beides Faktoren, die beim Menschen zu einem gesunden fettleibigen Phänotyp beitragen,“ so Dr. Müller.
Literatur
1. Müller C, Zidek LM, Eichwald S, et al.: Enhanced C/EBPβ function promotes hyperplastic versus hypertrophic fat tissue growth and prevents steatosis in response to high-fat diet feeding. eLife 2022, 11, e62625.
Quelle: Leibniz-Institut für Alternsforschung - Fritz-Lipmann-Institut e. V. (FLI), Pressemeldung vom 20.05.2022
Diesen Artikel finden Sie auch in ERNÄHRUNGS UMSCHAU 7/2022 auf den Seiten M353-M354.
